커피를 위한 물 (2) - 물의 특성, 미네랄

1. 물에 대한 것
순수한 물은 H2O 이다. 수소 두개와 산소 하나로 이루어져 있다. 수소와 산소는 각자의 전자를 '공유' 하면서 공유결합을 한다. (수소가 결합에 포함되어 있으면 수소결합이라고도 한다.) 대부분의 물질들은 자연계에서 안정된 상태로 가려고 한다. 그 상태를 '옥텟 규칙'을 만족했다고 하는데 보통 2주기 원소 부터 말하고 최외각 전자가 8개여야 한다. (영어로 octet이라는 뜻 자체가 8개가 모여있는 것을 의미한다.)
1주기 원소인 수소는 최외각 전자가 2개여야 안정한 상태이다. (듀엣 규칙)
2주기 원소인 산소는 최외각 전자가 8개여야 안정한 상태이다. (옥텟 규칙)
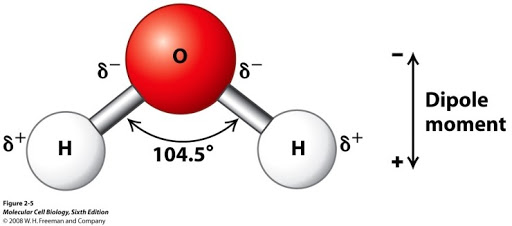
전자 2개가 필요한 산소는 수소와 한개씩 공유한다. 하지만 원래있던 산소의 전자가 4개 남아있으므로 결합각이 180도 보다 줄어들게 된다. (전자는 서로 붙어있지 않으려고 하기 때문)
이러한 모양으로 인해 '극성'이라는 현상이 나타난다. 위 그림의 산소쪽은 전자가 많아서 (-)전하를 띄고 상대적으로 수소 쪽은 (+)전하를 띈다.
이 극성이라는 성질이 어떤 물질이든 물에 잘 녹아들게 하는 효과를 준다.

우리가 알고있는 소금, 즉 염화나트륨(NaCl)은 평소엔 고체상태이지만 물에 들어가면 흔적도 없이 사라진다. 바로 녹았다는 뜻인데 이 녹임이라는 현상자체가 어떤 용매가 분자의 결합을 끊어버리는 현상이다. 위 사진과 같이 (+)전하인 수소는 (-)전하인 Cl(염소)와 달라붙고 반대로 (-)전하인 산소는 (+)전하인 Na(나트륨)과 달라붙어 소금의 결합(이온결합)을 깨버린다.
비극성분자에서는 이런 현상이 나타나지 않는다. 기름은 대표적인 비극성분자인데 소금을 녹이지 못한다. ex)기름장
위 현상으로 물 자체가 어떤 것을 녹이기에는 최적화 되어있다는 설명을 장황하게 했다.
2. 물속에 들어있는 것들, 미네랄, 양이온, 경도
순수한 물이 커피성분을 녹일 수도 있지만 물 속에 포함되어 있는 물질들이 큰 영향을 미칠 수도 있다. 우리가 미네랄이라고 부르는 것들이 그것이다. 미네랄은 몸에는 좋다고 익히 알려지긴 하였으나 너무 많아도 커피 추출에는 문제가 되고 너무 적어도 문제가 된다.
물 속에 포함된 미네랄, 양이온은 대표적으로 4가지가 있다. 마그네슘, 칼슘, 나트륨, 칼륨인데 나머지 물질들은 너무 미미하게 들어있기 때문에 생수를 구매하여도 따로 표시하지 않는다. 문제는 이 양이온마다 커피를 추출하는데 있어서 각각 다르다는 것이다.
각 미네랄들의 이온상태는 다음과 같다.
마그네슘(Mg2+)
칼슘(Ca2+)
나트륨(Na+)
칼륨(K+)
여기서 경도라는 개념이 등장하는데 보통 마그네슘과 칼슘을 이야기 한다. 물에 나트륨과 칼륨이 보통 미미하게 들어있기도 하고 추출력도 1가양이온으로 약하기 때문이다. 2가양이온은 전자가 2개 부족한 상태를 의미하므로 당연히 1개가 부족한 아이들 보단 안정된 상태로 가고자 하는 힘이 더 크다.
그중에서도 마그네슘이 가장 강하고 그다음이 칼슘이다. 커피를 추출하는데 있어서 물에 마그네슘 함량이 높다면 그만큼 성분추출이 잘 된다는 소리다. 하지만 역시 너무 많으면 문제가 된다. 다크 로스팅된 커피에 마그네슘 함량이 높은 물을 사용하면? 사약이 될 것이다.
양이온들이 많으면 경수, 적으면 연수로 표현한다.
보통 우리나라의 물은 연수에 속한다. 특히나 제주도, 전라도 지역은 미네랄이 없는편이다.
다음 포스팅은 물속의 음이온과 스케일에 대해서 말해보려고 한다.